Selvita zapaliła dzisiaj 1 mld zł wyceny. Spółka otrzymała zgodę FDA na rozpoczęcie badań klinicznych nad SEL120
Akcje spółki Selvita zakończyły dzisiejszą sesją ponad 8% wzrostem, a wycena rynkowa spółki w trakcie sesji przekroczyła 1 mld zł. Biotechnologiczna spółka z Krakowa otrzymała od FDA, amerykańskiego regulatora leków, zgodę na rozpoczęcie I fazy klinicznej badań cząsteczki SEl120 na terenie USA. To druga innowacyjna cząsteczka Selvity, która zostanie podana ludziom.
SEL120 otrzymuje zgodę na podanie pacjentom
SEL120 to małocząsteczkowy potencjalny lek na raka, który może znaleźć zastosowanie w leczeniu przede wszystkim nowotworów hematologicznych, ale także guzów litych jak raka jelita grubego czy sutka. Celem I fazy klinicznej badania jest ustalenie bezpieczeństwa i rekomendowanych dawek leku w dalszych etapach badań klinicznych. Wezmą w nim udział pacjenci cierpiących na ostrą białaczkę szpikową (AML). Podanie potencjalnego leku pierwszemu pacjentowi planowane jest nie później niż w III kw. bieżącego roku.
The US. Food and Drug Administration @US_FDA has accepted @SelvitaKrakow Investigational New Drug (IND) application for the first-in-class selective CDK8 inhibitor SEL120 in Acute Myeloid Leukemia and high risk Myelodysplastic Syndrome #AML #Leukemia #MDS https://t.co/uBtgcZCrvG pic.twitter.com/lv5hFRzf9Y
— Selvita (@SelvitaKrakow) 26 marca 2019
Związek SEL120 jest rozwijany przy strategicznej współpracy z Leukemia & Lymphoma Society (LLS). To największa na świecie fundacja z USA, której celem jest walka z nowotworami krwi. Współpraca Selvity i LLS dotyczy dalszego rozwoju przedklinicznego oraz klinicznego SEL120 w ostrej białaczce szpikowej (AML) oraz innych potencjalnych wskazaniach w obszarze nowotworów układu krwiotwórczego. Leukemia & Lymphoma Society zobowiązała się dofinansować prace rozwojowe programu kwotą do 3,25 mln USD.
- Oczekujemy, że do zakończenia I fazy badań klinicznych SEL120 pod koniec 2020 r., ich koszt wyniesie ok. 20 mln zł. Do tej pory z LLS otrzymaliśmy 1,1 mln USD. W związku z dopuszczeniem projektu do kliniki spodziewamy się wpłaty kolejnych 0,4 mln USD. Pozostaje więc ok. 1,8 mln USD, które możemy jeszcze otrzymać wraz z postępem badań klinicznych. Liczymy na kolejne kamienie milowe w tej współpracy jeszcze w 2019 r. - mówi Dr Krzysztof Brzózka, wiceprezes zarządu, dyrektor ds. naukowych Selvita S.A.
Zobacz także: Krzysztof Brzózka, Selvita: "W firmie biotechnologicznej chodzi o generowanie projektów, które będą wchodziły do kliniki"
Potencjał komercyjny SEL120 większy od SEL24
Warto zaznaczyć, że potencjał komercyjny cząsteczki SEL120 jest dużo większy od SEL24. W marcu 2017 roku na tą drugą cząsteczkę krakowska spółka biotechnologiczna podpisała z włoską spółką farmaceutyczną Menarini umowę komercyjną która opiewała na 379 mln zł.
- Potencjał jest dużo większy przede wszystkim ze względu na fakt, że SEL120 planujemy komercjalizować dopiero po zakończeniu fazy IIa badań klinicznych, czyli po wstępnych badaniach skuteczności. SEL24 sprzedaliśmy zaraz po uzyskaniu zgody FDA i przed rozpoczęciem podawania związku pacjentom w fazie I, której głównym celem jest eskalacja dawek, ocena bezpieczeństwa i określenie dawki rekomendowanej do II fazy badań klinicznych. Spodziewamy się, że wartość umowy, którą mamy nadzieję podpisać za 2-3 lata, będzie znacznie wyższa niż w przypadku kontraktu z Menarini. Typowa wycena notowanej na NASDAQ spółki biotechnologicznej z projektem onkologicznym w II fazie badań klinicznych oscyluje w okolicach 500 mln $. - mówi Brzózka
Wycena rynkowa spółki Selvita w mln zł
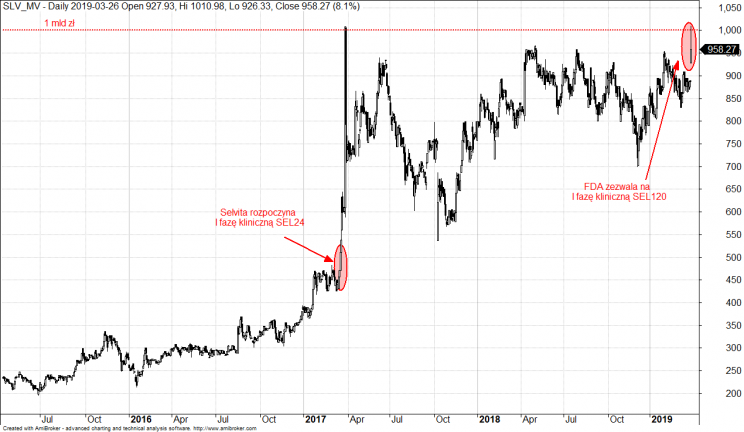
Rozpoczęcie badań klinicznych nad SEL24 w marcu 2017 roku zapoczątkowało mocny wzrost wartości rynkowej spółki Selvita. Od początku 2017 roku w krakowskiej spółce biotechnologicznej sporo się zmieniło. Selvita podpisała umowę komercyjną z Grupą Mennarini na SEL24. Projekt został już w pełni przekazany włoskim partnerom. Polska spółka ogłosiła nową strategię i plan rozwoju na który pozyskała w 2018 roku z emisji akcji 134 mln zł. Zgoda na wejście SEL120 do I fazy klinicznej badań to jeden z elementów realizacji tej strategii i kolejny przełomowy moment w historii spółki.
Zobacz także: Nagroda Nobla z medycyny 2018 przyznana za to, nad czym pracują dwie polskie spółki biotechnologiczne
Biotechnologiczna hossa na GPW się rozkręca
Zgoda FDA na rozpoczęcie I fazy badań klinicznych nad SEL120 to druga w tym roku dobra wiadomość dla branży biotechnologicznej na GPW. Na początku marca FDA zatwierdziła konkurencyjną cząsteczkę do najbardziej zaawansowanego projektu Celon Pharmy. Mowa o potencjalnym leku na depresję jedno i dwubiegunową polskiej spółki, który znajduje się w drugiej fazie klinicznej. Informacja o zatwierdzeniu esketaminu w leczeniu depresji, podobnie jak zgoda FDA na rozpoczęcie badań klinicznych nad SEL120 w przypadku Selvity, wywołała euforię wzrostów na kursie akcji biotechnologicznej spółki z Warszawy. Konsekwentnie rośnie na GPW nowa wzrostowa branża, która oprócz gier może być lokomotywą dla naszego rynku. Śledzimy ją od dłuższego czasu i widzimy, że nabiera ona coraz większego potencjału.