Optymistycznie patrząc, w połowie 2025 roku będziemy wiedzieć, czy RVU120 ma potencjał stać się zarejestrowanym lekiem - Paweł Przewięźlikowski CEO Ryvu Therapeutics
Ryvu Therapeutics zaprezentowało wstępne wyniki swoich programów klinicznych 2 fazy. O tym, jakie dane udało się zebrać po tym, jak cząsteczka RVU120 została podana prawie 100 osobom oraz kiedy możemy się spodziewać decyzji odnośnie do poszczególnych wskazań i dalszym rozwoju polskiego innowacyjnego leku na raka, rozmawiamy z CEO, założycielem i głównym akcjonariuszem biotechnologicznej spółki Pawłem Przewięźlikowskim.
Z tej rozmowy dowiesz się:
- Jakie dane udało się zebrać z czterech badań klinicznych 2 fazy dla RVU120.
- Kiedy można spodziewać się ostatecznych wyników i decyzji co do przyszłości programu?
- Jak w tej chwili wygląda pozycja gotówkowa spółki i czy planuje emisję akcji.
- Jak postępują prace w projektach przedklinicznych?
- Czy Ryvu Therapeutics pracuje nad jakąś komercjalizacją?
Paweł Biedrzycki: Ryvu Therapeutics podsumowało postępy w programie klinicznym RVU120 na konferencji inwestorskiej. Jak ostatnie 12 miesięcy minęło w spółce?
Paweł Przewięźlikowski: To był okres dynamicznego rozwoju naszej najważniejszej cząsteczki. Pod koniec ubiegłego roku zapowiedzieliśmy uruchomienie w 2024 czterech programów drugiej fazy klinicznej dla naszego inhibitora CDK8/19, z celem podania go około 100 pacjentom cierpiących na różne nowotwory układu krwiotwórczego. Wszystko wskazuje na to, że do końca grudnia cel ten zostanie osiągnięty. Dwa badania uruchomiliśmy w pierwszym kwartale w AML (ostrej białaczce szpikowej – red.), trzecie w obszarze LR-MDS (zespołów mielodysplastycznych niższego ryzyka – red.) we wrześniu, a ostatnie w grudniu w mielofibrozie. Obiecaliśmy również, że co pół roku, w rytmie najważniejszych światowych konferencji hematologicznych będziemy przedstawiać postępy prac w RVU120 inwestorom i dlatego tego właśnie programu dotyczyła nasza konferencja 12 grudnia.
Jakie dane zebraliście do tej pory z tych programów?
Po pierwsze, udało nam się potwierdzić możliwość skojarzenia naszej cząsteczki z wenetoklaksem, który jest najczęściej przepisywanym lekiem na ostrą białaczkę szpikową poza chemioterapią. Obok bardzo dobrych wyników bezpieczeństwa w monoterapii, potwierdziliśmy również wysoką tolerowalność w tej kombinacji. Obecnie w badaniu RIVER-81 widzimy, że podanie obydwu cząsteczek w maksymalnej dawce nie wywołuje dodatkowych skutków ubocznych. Mamy też pierwsze oznaki efektywności w AML. Do tej pory udało nam się uzyskać pełną odpowiedź u jednego z pacjentów i kilka wczesnych oznak efektywności u innych chorych. Lekarze są mocno zainteresowani tym programem i aktywnie zapisują pacjentów na naszą terapię. Dlatego zdecydowaliśmy o przejściu badania do drugiej części.
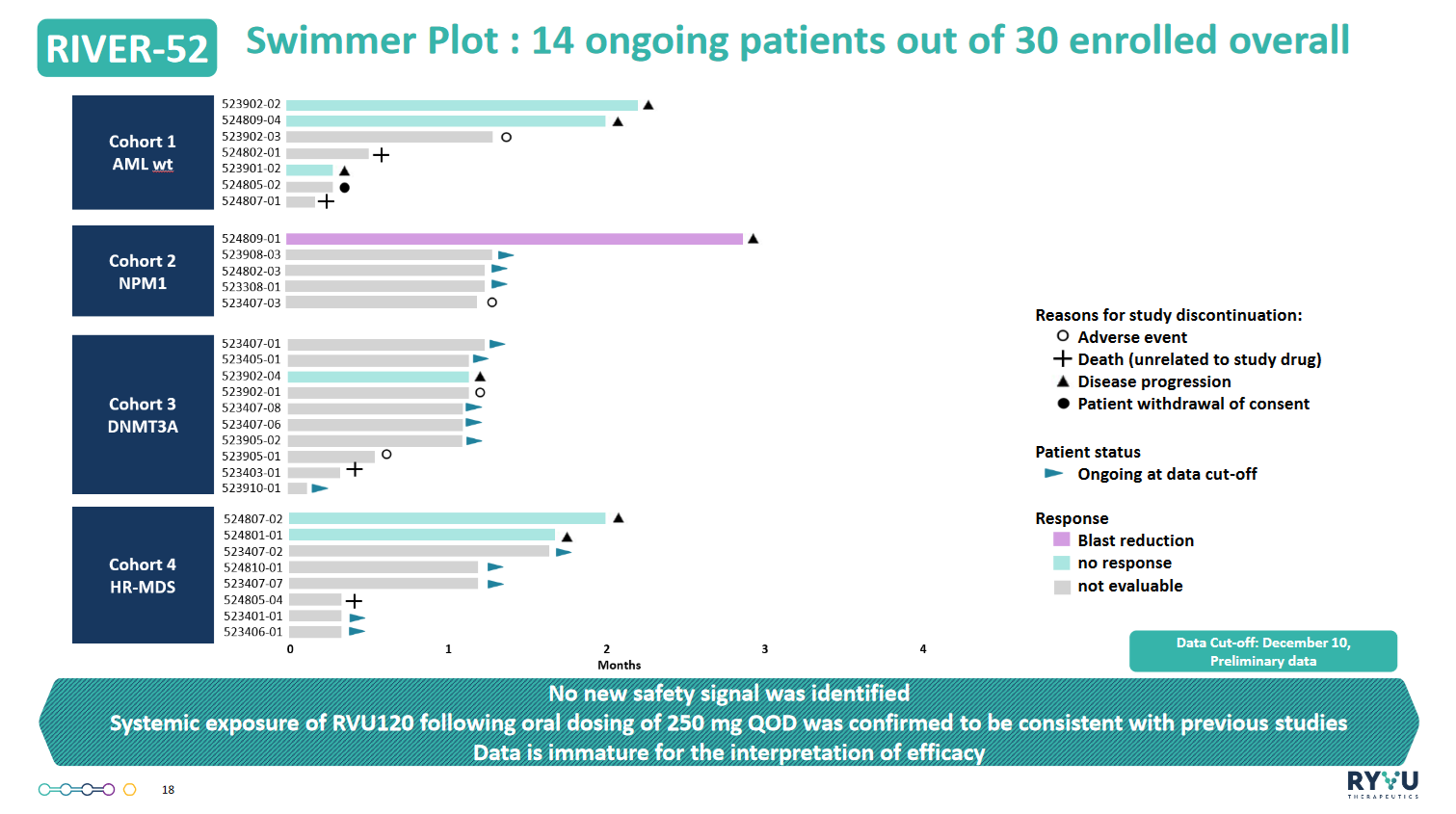
Co z badaniem RIVER-52, czyli wykorzystaniem RVU120 jako monoterapii w AML i HR-MDS?
Tutaj początkowo rekrutacja pacjentów nie odbywała się w satysfakcjonującym tempie, ze względu na niską wykrywalność mutacji genetycznych w Polsce i konkurencję badań inhibitorów meniny we Włoszech. Po zwiększeniu liczby ośrodków w tych krajach, a przede wszystkim uruchomieniu badania w Hiszpanii oraz Francji, rekrutacja znacząco przyspieszyła. Spodziewamy się rekrutacji 10 pacjentów w każdej z trzech kluczowych kohort – pacjentów z mutacjami NPM1 i DNMT3A cierpiących na AML oraz chorych na HR-MDS, czyli chorobę, która szybko przekształca się w AML – oraz wyników skuteczności z bardziej reprezentatywnej grupy pacjentów w Q1 2025.
Dane dla poszczególnych kohort dla badania RIVER-52
Źródła: spółka
Jak wygląda sytuacja z rozpoczętymi badaniami w drugiej połowie tego roku?
W przypadku REMARK, czyli monoterapii u pacjentów z LR-MDS, mówimy o mniej agresywnej chorobie. Tutaj, jak i w przypadku POTAMI-61, czyli badaniu RVU120 w monoterapii i skojarzeniu z ruksolitynibem, w leczeniu pacjentów z mielofibrozą, ewaluację pacjentów można przeprowadzić dopiero po trzech-czterech miesiącach. Na ten moment wszystko wskazuje na to, że pełny komplet wstępnych danych dotyczących projektów celujących w białaczkę uzyskamy w Q1 2025, a w przypadku LR-MDS i mielofibrozy w Q2 2025. Wtedy podsumujemy wyniki, porównamy je z konkurencją, porozmawiamy z kluczowymi badaczami i na tej podstawie podejmiemy decyzje w zakresie dalszych kierunków rozwoju programu RVU120.
Co to oznacza w praktyce?
Zgodnie z zapowiedziami, pracujemy nad tym, aby doprowadzić do momentu, w którym będziemy mieli wystarczająco dużo wyników badań i na tej podstawie zadecydować o kontynuacji w kierunku badań rejestracyjnych lub zakończeniu poszczególnych z nich. Jeśli jakieś dane będą szczególnie satysfakcjonujące, rozważymy ich rozszerzenie o większą liczbę pacjentów, być może kosztem innego badania. W przypadku atrakcyjnych wyników możemy też liczyć na partnerstwo i finansowanie dalszych badań bez angażowania kapitału akcjonariuszy. Optymistycznie patrząc, w połowie 2025 roku będziemy z dużą pewnością wiedzieć, czy RVU120 ma potencjał stać się zarejestrowanym lekiem. W takim scenariuszu proces rejestracji w pierwszych wskazaniach mógłby się rozpocząć już w 2026 roku. To by stanowiło o wysokiej wartości bazowej programu i dałoby bardzo szerokie pole do dalszego rozwoju RVU120 w innych chorobach nowotworowych.
Z rynkowego punktu widzenia największą wartość może wygenerować badanie RIVER-52. Jaką skuteczność musiałaby osiągnąć cząsteczka, aby projekt był kontynuowany?
Każde z badań daje nam perspektywy na innym rynku. AML jest najbardziej zwalidowanym klinicznie wskazaniem, ale z kolei najlepiej sprzedający się lek na LR-MDS – Reblozyl – osiąga już teraz poziom ok. 2 miliardów dolarów rocznie, z dużą dynamiką. „Na papierze” rynek mielofibrozy ma wartość ok. 3 mld dolarów, więc jest o ok. połowę mniejszy niż te wspomniane wcześniej, ale wartość transakcji partneringowych na wszystkich tych rynkach jest podobna, a w ostatnich latach przejęcia CTI, Sierra Oncology czy Morphosysa za kwoty powyżej 2 miliardów dolarów każde, pokazały ile może być warta cząsteczka bezpośrednio przed rejestracją. Nie należy oceniać rynków wyłącznie po ich globalnej wartości, kluczowe jest jeszcze m.in. otoczenie konkurencyjne, czy fragment rynku, jaki jest w stanie zaadresować dany lek.
Odpowiadając jednak na pytanie, w przypadku RIVER-52 kluczowe są dwa parametry: procent pełnych odpowiedzi, który powinien wynosić ponad 20%, oraz długość takiej odpowiedzi przekraczająca 5 miesięcy. Odsetek kompletnych odpowiedzi trzeba oceniać na końcu badania, bo pacjenci mogą je osiągać nawet po kilku miesiącach. Naszym najważniejszym benchmarkiem są inhibitory meniny. Na ten moment dane wskazują, że RVU120 charakteryzuje się niską kardiotoksycznością i nie powoduje syndromu różnicowania, które ograniczają niektóre z leków konkurencyjnych. Jeśli chodzi o efektywność, to mamy powody by liczyć, że osiągniemy zakładane parametry. Przebadaliśmy jednak na ten moment zbyt mało pacjentów, a terapia trwa zbyt krótko, by móc jednoznacznie odpowiedzieć, czy nam się to uda. Dużo więcej będziemy wiedzieli w ciągu najbliższych trzech-czterech miesięcy.
Do tej pory Ryvu Therapeutics komunikowało, że ma zabezpieczone finansowanie do pierwszego kwartału 2026 roku. Jak decyzje dotyczące badań mogą wpłynąć na ten parametr?
Nie mówimy o tym w szczegółach, bo na teraz jesteśmy w pełni skoncentrowani na optymalnym przeprowadzeniu badań – szybko i optymalnie kosztowo. Mamy zabezpieczone pełne finansowanie do Q1 2026. Należy jednak mieć świadomość, że wspomniana perspektywa zakłada, że wszystkie badania idą pełną parą. Można powiedzieć, że opiera się ona na scenariuszu, w którym wszystko idzie bardzo dobrze. A więc w każdym z badań raportujemy dobre wyniki, i każde z nich idzie do przodu na pełnej prędkości. Każdy pacjent w drugiej fazie klinicznej to w uproszczeniu koszt około 1 mln zł. Jeśli jednak wyniki uzasadniałyby priorytetyzację jednych badań kosztem innych, to decyzje o wstrzymaniu lub rozszerzeniu badań miałyby wpływ na budżet. Jeżeli wszystko w RVU120 i w projekcie RVU305, w którym mamy zarezerwowane 30 mln zł na rozwój, nam wyjdzie, cena akcji to odzwierciedli. Idziemy do przodu z maksymalną prędkością, i zgodnie z tym planem pieniądze wystarczą nam do początku 2026. Jeżeli nie będzie aż tak dobrze, ograniczymy koszty i wtedy wydłużymy pozycję gotówkową na dłuższy termin. Mamy to wszystko precyzyjnie policzone, i dokładnie wiemy jak poszczególne scenariusze wpłyną na nasz cash runway. W pełni świadomie zarządzamy całym pipeline Ryvu, biorąc pod uwagę zarówno to, co się dzieje po stronie badań, jak i w szeroko pojętym otoczeniu finansowym spółki – partneringowym, grantowym i giełdowym.
Należy pamiętać, że oprócz kapitału inwestorów oraz przychodów generowanych z partneringów – mam tu na myśli głównie umowy z BioNTech i Exelixis – rozwój programu możemy finansować z grantów. Jest tak już teraz w przypadku badania RIVER-81, w którym wykorzystujemy grant z ABM o wartości 60 mln zł, z którego ma wpłynąć do nas jeszcze ok. 50 mln, jeżeli badanie zrealizujemy z pełnym sukcesem. Czekamy w tym momencie na rozstrzygnięcie kilku innych konkursów. Równolegle prowadzimy stały dialog z uczestnikami rynku partneringowego. Istnieje wiele scenariuszy dla RVU120, natomiast kluczowe decyzje będą opierały się na wynikach badań.
Czy spółka planuje emisję akcji?
Nie pracujemy obecnie nad emisją akcji, i tym bardziej nie planujemy nikogo zaskoczyć jakąś transakcją opartą na kapitale docelowym, który wygasa wraz z końcem 2024 r. Nasze działania skupiają się na badaniach naukowych i tym, aby poszczególne projekty wygenerowały wartość dla pacjentów, co będzie prowadziło do zaspokojenia interesów pozostałych interesariuszy spółki.
Jakie projekty rozwijacie na wcześniejszych etapach?
Dużo dzieje się na zapleczu. Rozwijamy unikalną w globalnej skali platformę Onco Prime w obszarze syntetycznej letalności, która wspiera selekcję kandydatów w oparciu o bazę komórek nowotworowych pobranych bezpośrednio od pacjentów. Po współpracy z Exelixisem udowodniliśmy, że potrafimy pracować nad większymi cząsteczkami. Najważniejszym projektem na etapie przedklinicznym jest RVU305, czyli inhibitor PRMT5. Nasze dane wskazują, że projekt ma szanse osiągnąć skuteczność jako monoterapia oraz w kombinacji z innymi lekami. W przyszłym roku powinniśmy zbliżyć się w nim do kliniki.
Aktualny Pipeline Ryvu Therapeutics
W 2022 roku zapowiadaliście jeden partnering rocznie. Czy cel jest aktualny?
Podtrzymujemy te cele. Ryvu podpisało dotychczas 13 umów partneringowych na przestrzeni 17 lat. Ostatnie dwie umowy podpisaliśmy w 2022 roku, więc mamy pewne zaległości. Chcemy to nadrobić i usatysfakcjonować akcjonariuszy.
Jak wygląda obecnie dostęp do kapitału dla spółek biotechnologicznych w USA?
Widać lekką poprawę, choć punktem odniesienia jest niska baza. Dostęp do inwestorów giełdowych i venture capital się poprawił, ale finansowanie wciąż jest ograniczone, szczególnie poza obszarami takimi jak leki na odchudzanie.
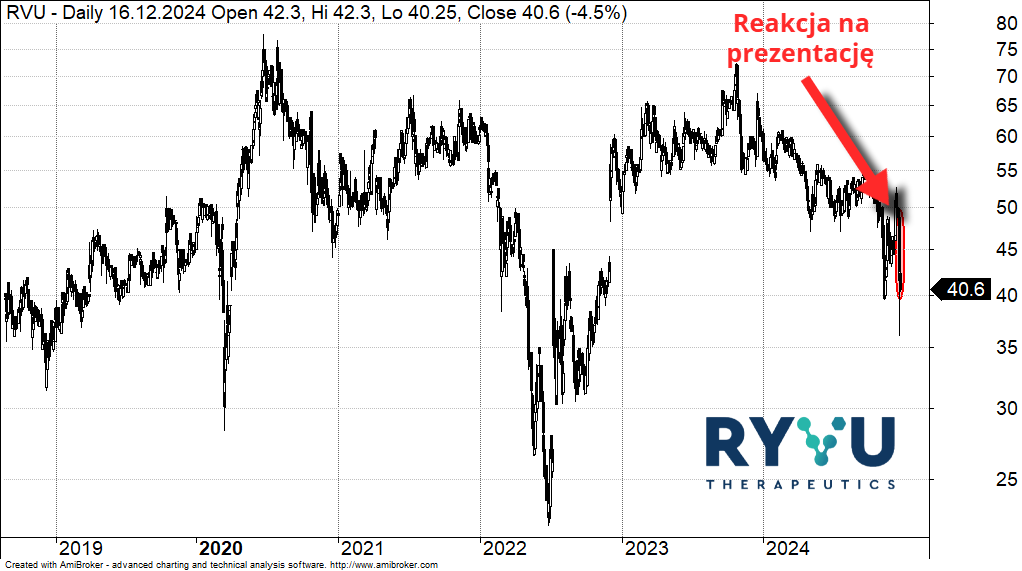
Kurs akcji Ryvu Therapeutics
Dlaczego w takim razie jest mniej partnerstw w branży?
Tych transakcji jest mniej z dwóch powodów. Po pierwsze, wysokie stopy procentowe utrudniają finansowanie i wyceny projektów. Po drugie, niepewność wokół procesów konsolidacji i M&A spowolniła rynek. W administracji prezydenta Bidena Federal Trade Commission blokowała wiele przejęć, co wpłynęło na przepływ kapitału. Liczymy, że w 2025 roku sytuacja ulegnie poprawie.